* Điện thế khuếch tán và điện thế cân bằng
– Điện thế khuếch tán (diffusionpotential) là sự chênh lệch điện thế được hình thành qua màng do sự chênh lệch nồng độ của một ion.
– Điện thế khuếch tán chỉ hình thành nếu màng thấm được với ion.
– Độ lớn của điện thế khuếch tán phụ thuộc vào độ lớn của sự chênh lệch nồng độ.
– Dấu của điện thế khuếch tán phụ thuộc vào bản chất ion khuếch tán mang điện tích dương hay âm.
– Điện thế khuếch tán được tạo ra nhờ sự khuếch tán rất ít ion, do đó nó không làm thay đổi nồng độ của ion khuếch tán.
– Điện thế cân bằng là vị trí mà chênh lệch điện thế chính xác cân bằng. Tại điểm cân bằng điện hóa, sự chênh lệch điện hóa thúc đẩy ion di chuyển cân bằng và không có sự khuếch tán thực.
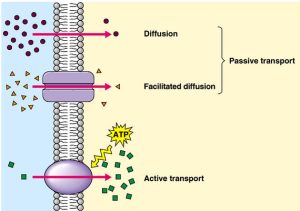
a. Ví dụ về điện thế khuếch tán của na+
– Hai dung dịch chất tan NaCl được phân chia bởi một màng chỉ thấm chọn lọc với Na nhưng không thấm Cl .Nồng độ NaCl ở dung dịch 1 cao hơn dung dịch 2.
– Bởi vì màng chỉ thấm với Na ,nên Na sẽ khuếch tán từ dung dịch 1 sang dung dịch 2 theo chiều gradient nồng độ. Cl không thấm và do đó nó không đi cùng Na .
– Kết luận: điện thế khuếch tán sẽ “phát triển” và dung dịch 1 sẽ trở nên âm hơn tương ứng với dung dịch 2.
– Cuối cùng, sự chênh lệch điện thế trở nên đủ lớn để xuất hiện dòng khuếch tán thực (net diffusion) Na theo chiều ngược lại. Vị trí mà chênh lệch điện thế chính xác khuếch tán dòng Na+ ngược lại, theo chiều gradient nồng độ được gọi là điện thế cân bằng Na+.
– Tại điểm điện thế cân bằng điện hóa, sự chênh lệch điện hóa thúc đẩy dòng ion di chuyển đạt cân bằng => không có sự khuếch tán thực của Na .
b. Ví dụ điện thế khuếch tán của Cl
– Hai dung dịch giống với hình 1.4, nhưng ở thí nghiệm này, màng phân chia là màng chỉ thấm chọn lọc Cl
– Cl sẽ khuếch tán từ dung dịch 1 sang dung dịch 2 theo chiều gradient nồng độ. Na không thấm và do đó nó sẽ không đi cùng với Cl .
– Điện thế khuếch tán sẽ được thiết lập như dung dịch 1 => dung dịch 1 trở nên dương hơn so với dung dịch 2. Sự chênh lệch điện thế tại vị trí chính xác khuếch tán đổi chiều dòng Cl , theo gradient nồng độ của nó được gọi là điện thế cân bằng Cl-
– Tại vị trí cân bằng điện hóa, sự chênh lệch điện hóa thúc đẩy dòng Cl- di chuyển đạt đượ ccân bằng => không có khuếch tán thực Cl .
c. Sử dụng công thức nernst để tính toán điện thế cân bằng
– Công thức nernst được sử dụng để tính điện thế cân bằng của ion thấm qua màng tế bào.
Copy ghi nguồn: https://brabantpharma.com
Link bài viết: Điện thế khuếch tán và điện thế cân bằng














Bạn cho mình hỏi với ạ: Điện thế Nernst áp dụng đối với nồng độ ion sau khi cân bằng hay trước khi cân bằng? Và nếu nồng độ trước và sau không thay đổi nhiều thì tại sao? Vì mình nghĩ để tạo được điện thế thì cần nhiều ion dịch chuyển qua? Hy vọng sẽ được giải đáp vì nó sẽ giúp mình chắc chắn hơn trong một vài ý nghĩ.